齐鲁医院超声科李杰教授团队长期致力于肿瘤诊疗一体化体系构建、纳米级超声造影剂的制备与优化、无创性和可视化精准诊疗等相关领域的基础和临床研究。近期,团队成员在纳米级超声造影剂逆转肿瘤耐药、诱发铁死亡、精准增强肿瘤诊疗方面取得系列研究成果,先后有3篇学术论文发表在ACS Applied Materials and Interfaces(JCR 1区,IF=10.383)、Cancer Nanotechnology(JCR 2区,IF=7.917)和在International Journal of Nanomedicine(JCR 2区,IF=7.033),山东大学齐鲁医院为上述论文的第一作者和通讯作者单位,超声科主治医师肖珊、主治医师孟冬和硕士研究生刘蕊分别为上述论文的第一作者,李杰教授为上述论文的唯一通讯作者。
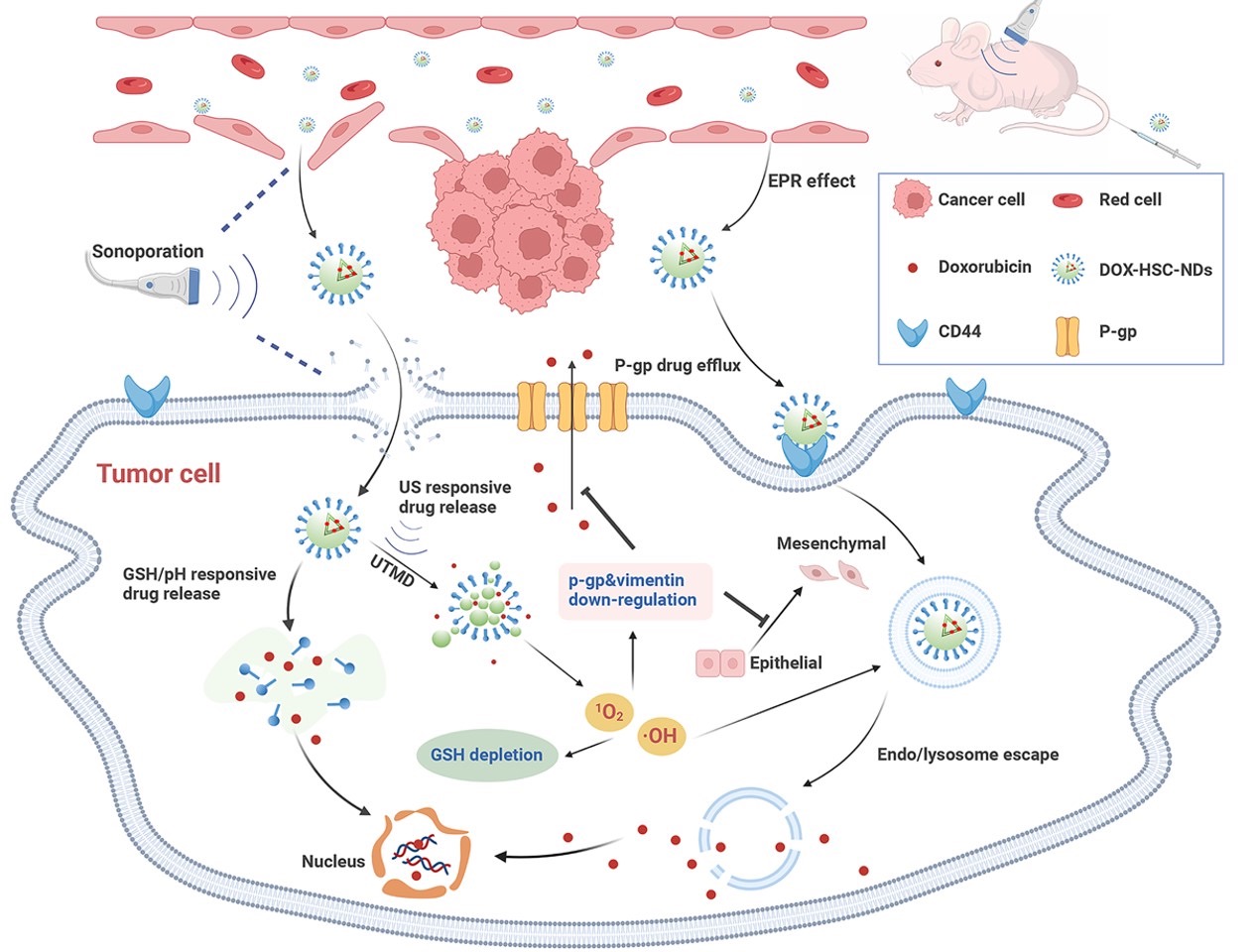
2023年2月,李杰教授团队发表题为“pH-/Redox-Responsive Nanodroplet Combined with Ultrasound-Targeted Microbubble Destruction for the Targeted Treatment of Drug-Resistant Triple Negative Breast Cancer”的研究论文。为解决癌症治疗领域长期存在的肿瘤靶向性和耐药性问题,该研究构建了具有pH/还原/超声多重响应和透明质酸靶向功能的纳米载体,实现可控和可视化的精准药物递送。在超声靶向微泡破坏技术作用下,脂质过氧化和纳米载体气化过程共同破坏溶酶体膜,帮助纳米载体实现溶酶体逃逸,提高肿瘤细胞内药物浓度。同时,将“超声靶向微泡破坏技术产生的活性氧”与“活性氧相关耐药机制”结合起来,通过下调多药耐药转运蛋白表达、抑制上皮-间质转化、促进凋亡和消耗肿瘤细胞内谷胱甘肽,协同干预多条耐药机制,有效提高肿瘤化疗敏感性,抑制肿瘤生长和转移,为耐药肿瘤的诊疗提供了一种新的技术手段。
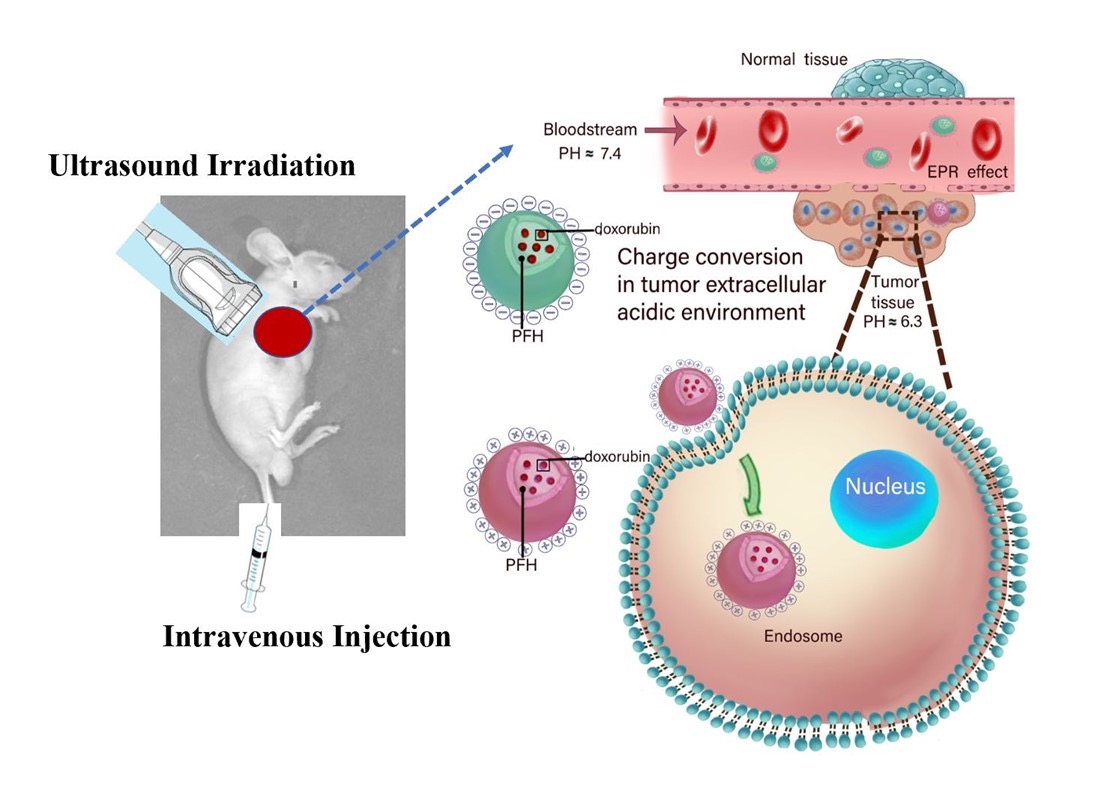
2023年3月,李杰教授团队发表题为“Dual-sensitive and highly biocompatible O-carboxymethyl chitosan nanodroplets for prostate tumor ultrasonic imaging and treatment”的研究论文,报道了O-羧甲基壳聚糖/全氟己烷纳米平台对前列腺癌的超声诊疗价值。该研究构建的纳米药物递送平台以内源性pH响应的O-羧甲基壳聚糖为外壳,以可稳定实现超声显像能力的全氟己烷为内核,同时包裹化疗药物阿霉素。该纳米级超声造影剂可以在超声和pH处理下实现包裹药物的定向释放,具备较高的生物安全性,并且在超声辐照下有效抑制前列腺癌细胞的生长,为前列腺癌的治疗提供了新的纳米平台和治疗策略。
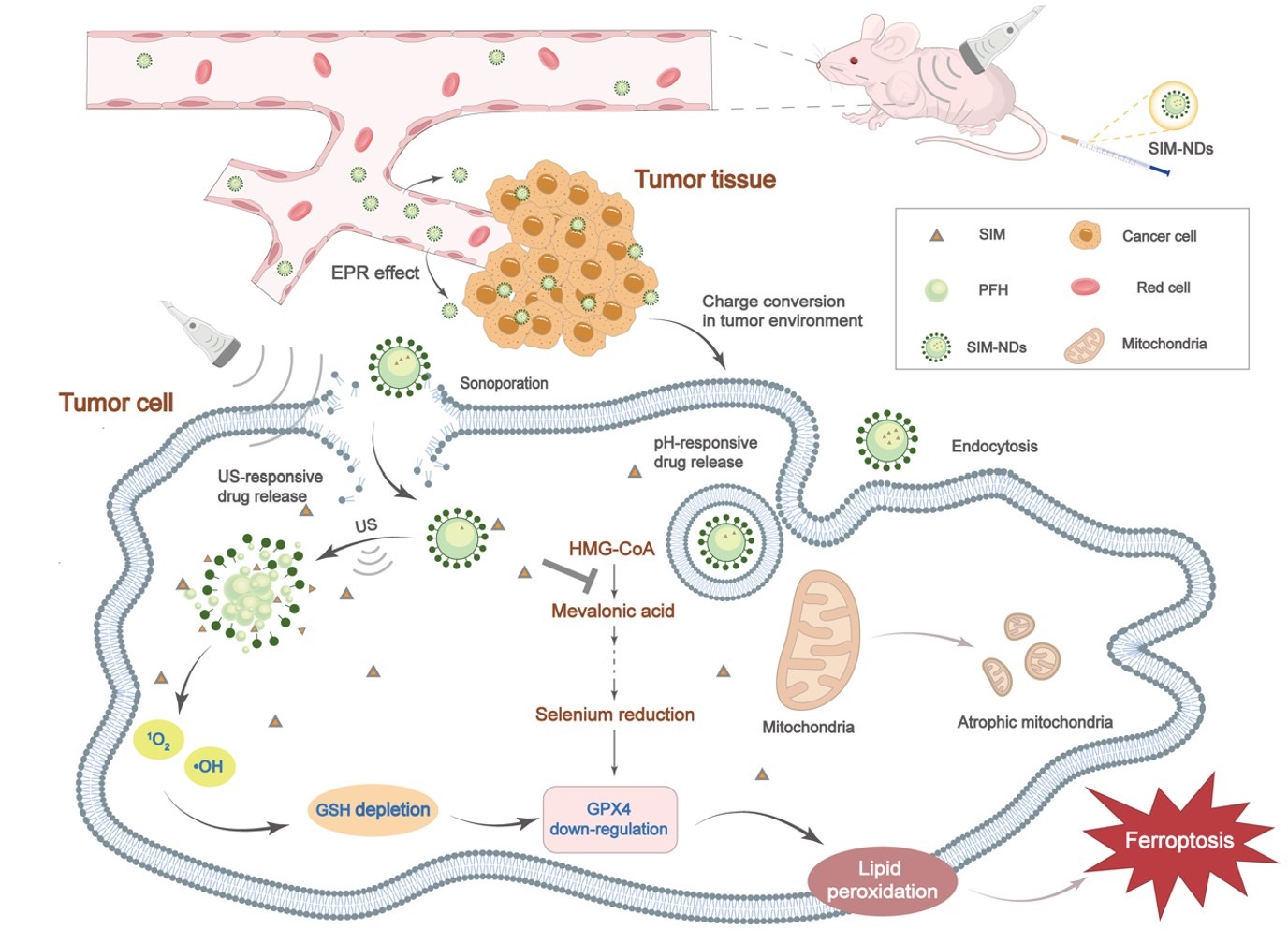
2023年4月,李杰教授团队发表题为“Ultrasound-targeted microbubble disruption with key nanodroplets for effective ferroptosis in triple-negative breast cancer using animal model”的研究论文,报道了超声靶向微泡破坏技术联合纳米级超声造影剂诱发铁死亡及其抑制肿瘤生长的应用。谷胱甘肽过氧化物酶4(GPX4)为肿瘤细胞中铁死亡的核心抑制因素,在细胞内的表达主要依赖于谷胱甘肽(GSH)和硒。该研究构建了携载辛伐他汀、具有双重响应性(超声响应、酸性响应)的纳米级超声造影剂,证实了该纳米级超声造影剂富集在肿瘤部位,在超声辐照下可控性释放辛伐他汀,抑制甲羟戊酸通路从而降低硒元素转运,同时,通过超声靶向微泡破坏技术诱导细胞产生活性氧、消耗细胞内GSH,两条途径分别通过降低细胞内GSH水平(UTMD的作用)和减少硒元素转运(SIM的作用)来协同下调GPX4,诱导铁死亡的发生,能够有效抑制肿瘤生长,这可能为铁死亡治疗的临床转化提供了新的视角。
相关链接:https://pubs.acs.org/doi/10.1021/acsami.2c20478
https://doi.org/10.1186/s12645-023-00172-z
https://www.researchgate.net/publication/370136057