动脉粥样硬化的靶向干预可有效避免全身给药的不良反应,有望预防斑块破裂和急性心脑血管事件。由于血管病变周围的高速血流环境,常规微纳药物载体在血管内皮细胞的附着和斑块内的富集受到阻碍。中性粒细胞作为“炎症”哨兵,具有多个炎性因子位点,可响应炎性趋化并对抗高剪切力血流环境,可与炎症区域的内皮细胞有效结合。张鹏飞教授课题组利用中性粒细胞的这些特性,研制了仿生中性粒细胞-微泡复合体Neu-balloon,发现Neu-balloon具有对抗高血流剪切力、通过微泡声学对比性能实现超声示踪和病变定位以及通过UTMD效应促进荷载的靶向药物进入斑块的优点。此外,Neu-balloon解决了多种类型干预药物的共转运难题。虽然中性粒细胞荷载容积大,但难以荷载生物分子如寡核苷酸、蛋白质等,而微泡则提供了生物活性大分子的荷载空间。本研究成功实现了ICG和MiR-126a-5p的共转运,证实ICG最大荷载量为2.9μg/105,在Neu-balloon注射后48小时于斑块内检测到MiR-126a-5p高表达而MCP-1、IL-6、ICAM-1等炎症因子的表达降低,表明MiR-126a-5p可通过Neu-balloon靶向转运至斑块中并发挥抗炎作用,转运效率明显高于传统靶向微泡,有望成为一种以细胞为基础的基因治疗载体。该成果以“Bionic microbubble neutrophil composite for inflammation-responsive atherosclerotic vulnerable plaque pluripotent intervention”为题发表于国际权威期刊《Science》的合作期刊《Research》。
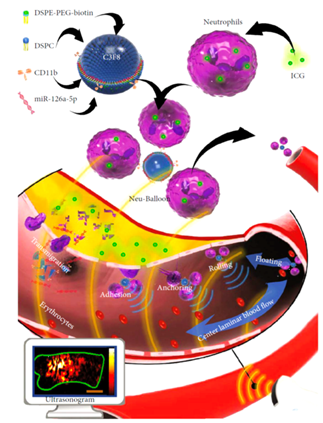
Neu-balloon结构图与靶向诊疗一体化干预原理